解鎖間質幹細胞的潛力:從特徵鑑定到體外培養
本文由Pricella提供
間質幹細胞(Mesenchymal Stem Cells,簡稱 MSCs)是成體幹細胞,因其獨特的生物特性與卓越的治療潛力,已成為疾病研究領域的明星。截至2024年5月,全球已有超過1,200項與MSCs相關的臨床試驗正在進行,並有超過27項MSC相關產品獲得批准,初步證明了其臨床價值。
為幫助使用者快速且系統性地掌握MSCs的核心知識,我們規劃了一系列文章,依序涵蓋以下主題:MSCs概述、體外培養與擴增、三系分化能力,以及細胞治療應用。
在本期《細胞培養學院》中,我們將全面介紹MSCs,包括其關鍵特徵、生物功能、研究應用及體外培養策略,讓您迅速熟悉這一尖端研究領域。
一、MSCs的基本特性
間質幹細胞起源於中胚層,具備強大的自我更新與多向分化潛力。其主要特徵包括:自我更新能力(self-renewal)、低免疫原性 (low immunogenicity)、高存活率(high viability)、趨化反應性(chemotactic responsiveness),以及非腫瘤性(non-tumorigenicity),這些特性使其在生物醫學研究中備受關注。
國際細胞與基因治療學會(ISCT)制定了鑑定MSCs的最低標準:
- 貼壁性(Adherent):在標準培養條件下,MSCs必須能夠貼附於塑膠表面。
- 表面標記(Surface markers):MSCs必須表達CD105、CD73和CD90,且不表達CD45、CD34、CD14或CD11b、CD79α或CD19,以及HLA-DR。
- 分化潛力(Differentiation potential):MSCs必須能在體外分化為成骨細胞(osteoblasts)、脂肪細胞(adipocytes)和軟骨細胞(chondroblasts)。
註:隨著MSCs研究的進展,ISCT的鑑定標準可能會進一步修訂或更新。
MSCs可從多種組織中分離,包括骨髓(bone marrow)、臍帶(umbilical cord)、脂肪組織(adipose tissue)、牙齒(teeth)及胎盤(placenta),並具備分化為多種細胞類型的能力(見圖1)。
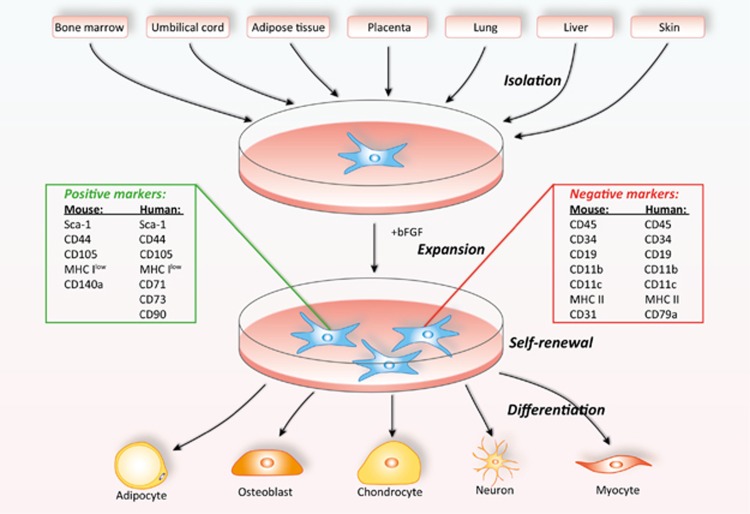
圖1. MSCs的組織來源與分化潛力(引用自參考文獻[1])
不同來源的MSCs在細胞產量、增殖能力及功能特性上存在顯著差異,這些差異對其在研究與臨床應用中的選擇具有關鍵意義。常見來源的MSCs特性總結如下表:
| 細胞類型 | 組織來源 | 主要特徵 |
| BM-MSCs | 骨髓抽吸Bone marrow aspirate(侵入性操作) | 研究歷史最久;分化潛力穩定;免疫調節機制明確;細胞產量有限;增殖與分化能力受年齡影響 |
| UC-MSCs | 新生兒臍帶
Neonatal umbilical cord (出生後廢棄物) |
來源豐富;高增殖能力;低免疫原性;適合異體應用 |
| AD-MSCs | 脂肪組織Adipose tissue(抽脂獲取) | 細胞產量高;取得容易;增殖能力強;分化潛力略低於BM-MSCs |
| SF-MSCs | 關節滑液Joint synovial fluid(關節穿刺) | 細胞產量低;分化潛力中等;具免疫調節活性 |
| P-MSCs | 胎盤組織Placental tissue(出生後廢棄物) | 來源豐富;免疫調節能力強;增殖潛力高 |
| DP-MSCs | 牙髓Dental pulp | 細胞產量有限;來源受限於牙齒取得;增殖能力佳;具神經分化潛力 |
二、MSCs的核心功能
MSCs的治療潛力主要來自其四大生物功能,這些功能協同作用,促進組織再生並提升臨床應用價值:
- 自我更新與增殖能力(Self-Renewal and Proliferative Capacity)
MSCs具備強大的自我更新與增殖能力,能持續分裂、產生新幹細胞,維持族群穩定與功能完整。
- 多向分化潛力(Multilineage Differentiation Potential)
MSCs可分化為多種細胞類型,包括成骨細胞、軟骨細胞、脂肪細胞、心肌細胞及神經細胞等。
- 組織修復與再生(Tissue Repair and Regeneration)
MSCs分泌多種生長因子與免疫調節細胞激素 immunomodulatory cytokines,並建立支持性微環境,促進細胞修復與組織重塑。
- 免疫調節功能(Immunomodulatory Function )
MSCs能有效調節免疫細胞活性,減緩過度的炎症反應,並促進免疫耐受性。
三、MSCs的研究與應用(Research and Applications of MSCs)
憑藉其多功能特性,MSCs已在多種臨床前模型與臨床試驗中廣泛研究,涵蓋自體免疫(autoimmune)與炎症性疾病(inflammatory disorders)、神經退化性疾病(neurodegenerative diseases)、骨科損傷(orthopedic injuries)等多種病症(見圖2)【2-4】。
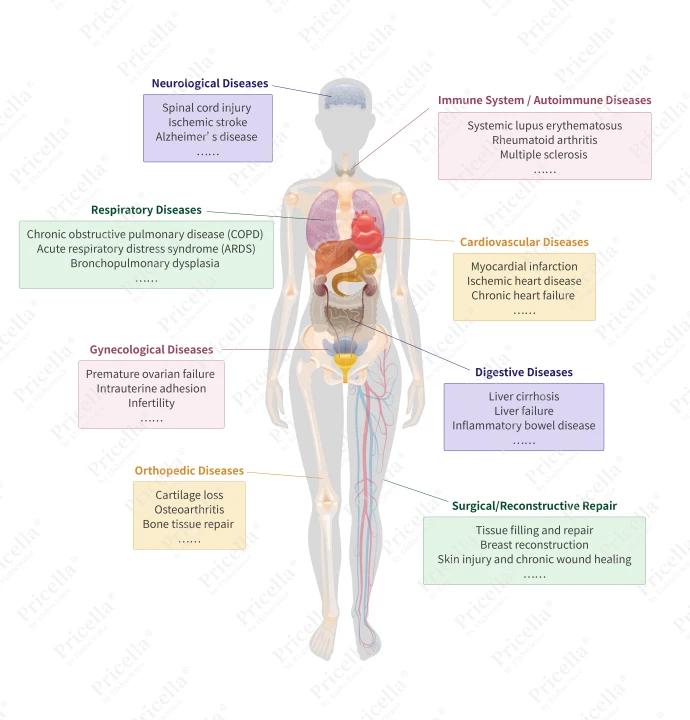
不同組織來源的MSCs在疾病治療中的代表性應用
來自不同組織來源的間質幹細胞(MSCs)展現出各異的生物特性、免疫調節能力與分化潛力。這些差異影響其在特定疾病治療中的適用性與潛在優勢。選擇最適合某一病理狀況的MSC來源仍是當前研究的重點領域【2-3】(見表2)。
表2. 主要組織來源的MSCs在疾病治療中的代表性應用
| 細胞類型 | 治療應用 | 主要特徵 |
| BM-MSCs(骨髓) | 骨關節炎Osteoarthritis、脊髓損傷、移植物抗宿主病(GVHD)、肌萎縮性側索硬化症(ALS)、心血管疾病cardiovascular disorders、內endocrine dysfunction分泌功能障礙、輔助生殖技術assisted reproductive technologies | 免疫調節機制明確;具備豐富的長期安全性數據 |
| UC-MSCs(臍帶) | 心肌梗塞Myocardial infarction、肝纖維化liver fibrosis、神經退化性疾病neurodegenerative diseases、呼吸系統疾病respiratory disorders | 低免疫原性,適合異體移植allogeneic transplantation;來源不受年齡限制且易於取得 |
| AD-MSCs(脂肪) | 整形與重建手術Plastic and reconstructive surgery(組織增生與修復、乳房重建)、關節炎arthritis 與軟骨cartilage修復、傷口癒合wound healing、自體免疫疾病autoimmune disease治療、心血管疾病cardiovascular disorders | 細胞產量高;具強脂肪分化與纖維母細胞分化潛力;適合軟組織再生 |
- MSCs的體外培養策略
隨著幹細胞治療需求日益增加,MSCs的體外擴增 (in vitro expansion) 變得愈加重要。選擇合適的培養系統與方法,不僅有助於維持MSCs的特性,也能最大化其轉譯(translational)與臨床應用潛力。
- 培養系統
目前常用的培養系統包括含血清培養基(serum-containing media)、無血清培養基(serum-free media),以及添加血清替代物(serum alternatives)的培養基(見表3)。
表3. MSCs體外培養系統的比較分析
| 培養系統 | 優點 | 限制 | 典型應用 |
| Cell Complete Medium(完整培養基) | 成本低;實驗室易取得;細胞適應性高 | 批次間差異大;可能存在臨床風險 | 基礎研究;常規MSC擴增 |
| Serum-free Medium(無血清培養基) | 化學成分明確;不含血清與動物來源成分;批次穩定性高;可產生高純度外泌體exosome | 成本較高;部分MSC類型適應性差 | 外泌體研究Exosome research;藥物開發drug development |
| Serum-free Medium with Serum Replacement(無血清培養基加血清替代物) | 提供類似血清(serum-mimicking)的營養;降低血清相關風險;成本中等 | – | 一般研究;臨床前(preclinical)研究 |
- 培養方法
MSCs可採用二維(2D,傳統)或三維(3D)培養方式。
在2D培養中,細胞附著並在培養容器的平面表面生長。此方法簡單、成本低,廣泛應用於再生醫學與基礎幹細胞研究。
然而,2D培養與體內的自然3D微環境(microenvironment )差異顯著。MSCs在平面表面生長容易出現形態改變morphological changes、增殖動態異常altered proliferation kinetics、分化潛力下降reduced differentiation potential。長期2D培養還可能導致幹性喪失loss of stemness、細胞早衰premature cellular senescenc與基因穩定性降低diminished genomic stability。
為克服上述限制,3D培養技術應運而生。3D培養提供更接近體內環境的微環境,可採用無支架球體scaffold-free spheroids或有支架系統scaffold-based systems像水凝膠hydrogels(eg. 海藻酸鹽alginate、膠原蛋白collagen、Matrigel)。此方式讓MSCs在空間結構中生長、增殖與遷移,維持其原生形態與功能特性。
儘管3D培養技術要求較高、成本較高且標準化困難,但在模擬體內生理環境與維持MSCs生物特性方面具有顯著優勢。培養方法的選擇應根據實驗的具體目標而定。
References
[1]Chen Q, Shou P, Zheng C, et al. Fate decision of mesenchymal stem cells: adipocytes or osteoblasts?. Cell Death & Differentiation. 2016; 23 (7): 1128-1139.
[2]Zhidu S, Ying T, Rui J, et al. Translational potential of mesenchymal stem cells in regenerative therapies for human diseases: challenges and opportunities. Stem Cell Research & Therapy. 15, 266 (2024).
[3]Zhou J, Shi Y, et al. Mesenchymal stem/stromal cells (MSCs): origin, immune regulation, and clinical applications. Cellular & Molecular Immunology. 20, 555–557 (2023).
[4]Han X, Liao R, Li X, et al. Mesenchymal stem cells in treating human diseases: molecular mechanisms and clinical studies. Signal Transduction and Targeted Therapy. 10, 262 (2025).
[5]Li J, Wu Z, Zhao L, et al. The heterogeneity of mesenchymal stem cells: an important issue to be addressed in cell therapy. Stem Cell Research & Therapy. 2023; 14 (1): 381.
[6]Moldaschl J, Chariyev-Prinz F, Toegel S, et al. Spheroid trilineage differentiation model of primary mesenchymal stem/stromal cells under hypoxia and serum-free culture conditions. Frontiers in Bioengineering and Biotechnology. 2024; 12: 1444363.
Bicer M, Cottrell GS, Widera D. Impact of 3D cell culture on bone regeneration potential of mesenchymal stromal cells. Stem Cell Research & Therapy. 2021; 12 (1): 31.



